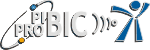LAVOISIER
"Na natureza nada se cria, nada se perde, tudo se transforma."

Antoine Laurent de Lavoisier nasceu em Paris em 26 de agosto de 1743 e faleceu em Paris em 8 de maio de 1794. De origem abastada, foi incentivado a fazer Direito, mas seu interesse pela ciência for maior, dedicando-se à química até o final de seus dias. É considerado o Pai da Química Moderna ou o Newton da Química. Caracterizava-se pela importância que dava às medidas acuradas nos seus experimentos. Em 1760 contribuiu para melhorar a iluminação das cidades e em 1770 definiu novos métodos para a produção de salitre, substância necessária à fabricação da pólvora. Segundo Asimov, ele cometeu 2 erros na sua vida. O primeiro foi investir 1 milhão de francos na Ferme Generale, firma particular de coleta de impostos para o governo e que o povo odiava. O dinheiro que ganhava investia na pesquisa química. Em 1768, com apenas 23 anos, foi admitido na Academia Francesa de Ciências e em 1771 casou-se com a bela e rica Marie Anne, que se tornou sua importante assistente. Em 1780, Jean-Paul Marat, um medíocre “cientista”, candidatou-se a uma vaga na Academia e Lavoisier foi contra sua admissão. Este foi seu segundo grande erro. Foi guilhotinado pela Revolução Francesa por ser coletor de impostos, tendo como principal acusador Jean-Paul Marat.

Lavoisier é conhecido como o introdutor da Química Moderna. Em 1789 lançou uma publicação que é considerada o marco da Química Moderna, "Tratado Elementar da Química", que logo foi traduzido para várias línguas. A freqüente utilização da balança pode ser considerada uma das principais características do seu trabalho de pesquisa. Isso o levou à descoberta da importância fundamental da massa da matéria em estudos químicos, e que o levou a concluir que a soma das massas dos reagentes é igual à soma das massas dos produtos de uma reação, ou seja, a famosa "Lei da conservação das massas".


Lavoisier criou uma nomenclatura das substâncias químicas semelhante à que ainda está em uso; surgiram, assim, os compostos do oxigênio, enxofre e fósforo, respectivamente. Deve-se a ele também a conclusão de que a água é uma substância composta, formada por hidrogênio e oxigênio. Isso, na época, foi surpreendente, pois a água era tida como substância simples, ou seja, impossível de se decompor.

.jpg)
Lavoisier não descobriu exatamente o oxigênio. Este gás foi descoberto independentemente por dois químicos: Carl Wilhelm Scheele em 1772 e Joseph Priestley em 1774. Em Outubro de 1774, Priestley visitou Paris e conversou com Lavoisier sobre as suas experiências. Este fato permitiu a Lavoisier refazer as experiências de Priestley e reformulá-las. Dessa forma, Lavoisier pode compreender melhor as características do novo gás. Confirmou também que a combustão e a calcinação correspondem à combinação do oxigênio com outros materiais (materiais orgânicos na combustão e metais na calcinação). Lavoisier deu ao novo gás o nome de oxigênio (produtor de ácidos em grego), porque considerava (erroneamente) que todas as substâncias originadas de uma calcinação originavam ácidos, em que o oxigênio se encontrava obrigatoriamente presente. Por volta de 1789 ele formulou o princípio da conservação da matéria.

![]()
CD-ROM Multimídia
Copyright 2011© - Todos os direitos reservados.
XVII Seminário Anual PIBIC, VIII Seminário Anual PROBIC e I Seminário Anual PIBITI - 2011